К вопросу о получении плазмы, обогащенной тромбоцитами
Развитие клеточных технологий и поиски эффективных методов стимуляции регенеративных процессов привели к изучению свойств аутологичной плазмы, обогащенной тромбоцитами, или Platelet Rich Plasma (PRP), которая впервые исследована в Калифорнийском университете в 1965 г. Было выявлено, что из α-гранул тромбоцитов в случае их разрушения и активации в плазму выделяются различные биоактивные вещества, включая фактор роста тромбоцитов (PDGF), трансформирующий фактор роста бета (TGF-β) и эпидермальный фактор роста (EGF). Данные факторы содержатся в раневых экссудатах, способствуют пролиферации и ангиогенезу на ранних стадиях процесса заживления, а также являются ключевыми сигналами в восстановлении и регенерации тканей.
В настоящее время имеется достаточная доказательная база и научное обоснование применения PRP при лечении различных заболеваний. PRP с успехом используется в клинической практике косметологов, стоматологов, ортопедов-травматологов, урологов, общих хирургов и во многих других областях медицины. Несмотря на все более широкое использование PRP в терапевтических целях, ее клинические эффекты весьма разнообразны. PRP может стимулировать пролиферацию дермальных фибробластов человека и увеличивать синтез коллагена I типа in vitro. Кроме того, согласно гистологическим данным, PRP при введении в глубокую дерму и непосредственно подкожную клетчатку вызывает активацию фибробластов и отложение нового коллагена, а также образование новых кровеносных сосудов и жировой ткани. PRP используется в регенеративной медицине для лечения язв, заболеваний опорно-двигательной системы, а также для восстановления тканей после операции, улучшения кровообращения при хронических ранах, связанных с невропатиями и сосудистыми заболеваниями.
Еще одно применение PRP – это лечение послеожоговых, послеоперационных рубцов и рубцов от угревой сыпи. Препараты PRP, полученные при помощи разных
технологий, различаются по качественному и количественному составу компонентов. В зависимости от количественного содержания в препаратах лейкоцитов
и фибрина их можно разделить на 4 группы:
• чистая обогащенная тромбоцитами плазма крови (P-PRP – Pure Platelet Rich Plasma);
• обогащенная лейкоцитами и тромбоцитами плазма крови (L-PRP – Leucocyte and Platelet Rich Plasma);
• чистый обогащенный тромбоцитами фибрин (P-PRF – Pure Platelet Rich Fibrin);
• обогащенный лейкоцитами и тромбоцитами фибрин (L-PRF – Leucocyte and Platelet Rich Fibrin).
Количественный и качественный клеточный состав образца плазмы имеет важное значение. Большинство авторов сходятся во мнении, что терапевтической концентрацией следует считать содержание тромбоцитов не менее 106/мкл.
Несмотря на то что сейчас доступно множество коммерческих устройств для клинического приготовления PRP, стандартизованного протокола пока не существует. Более того, мало научных исследований, посвященных тому, как оптимизировать приготовление PRP человека. Например, не проводилось всестороннего исследования, каким образом центробежная сила, действующая на образцы периферической крови при центрифугировании, влияет на характеристики PRP. В связи с этим настоящее исследование посвящено разработке оптимизированного и воспроизводимого метода приготовления PRP, а также характеристике содержания тромбоцитов и лейкоцитов в полученных фракциях при разных режимах центрифугирования.
Цель исследования
Определить оптимальные технологические режимы для приготовления аутоплазмы, обогащенной тромбоцитами, при использовании стандартного лабораторного оборудования.
Материал и методы
Кровь для исследования забирали в вакуумные пробирки в объеме 5 мл из локтевой вены у здоровых добровольцев. Для сепарации форменных элементов крови в пробирке применяли стандартную лабораторную центрифугу СМ-6М. Всего проведено 65 исследований концентрации тромбоцитов в полученных образцах плазмы. В группу 1 вошли 45 исследований, проведенных с использованием вакуумных пробирок 13×100 мм с литий-гепарином. При этом все они были разделены на 3 подгруппы по 15 пробирок в зависимости от режима центрифугирования. В 1-й подгруппе применялся режим 1000 об./мин в течение 5 мин, что для центрифуги СМ-6М соответствовало центробежной силе в 184 g. Во 2-й подгруппе центрифугирование осуществляли со скоростью 1500 об./мин (415 g) в течение 10 мин. В подгруппе 3 применялся режим 3000 (1660 g) об./мин в течение 10 мин. Выбор режимов центрифугирования подбирали эмпирически.
В группе сравнения кровь забирали в 20 вакуумныпробирок 13×100 мм, содержащих помимо литий-гепарина сепарационный гель. Режим центрифугирования для группы сравнения был выбран со скоростью 2000 об./мин (738 g) в течение 10 мин, так как данный режим рекомендован производителем для получения PRP. После окончания центрифугирования визуально разделяли плазму на верхний, средний и нижний слой и отбирали по 800 мкл из каждого слоя в трех независимых пробах (рис. 1).
Рисунок 1. Области для отбора проб обогащенной тромбоцитами плазмы после центрифугирования образцов
Образцы окрашивали по Паппенгейму, считали количество тромбоцитов и лейкоцитов до центрифугирования и в каждом из слоев после центрифугирования. Подсчет клеточных элементов крови проводился в камере Горяева и по методу Фонио, в дальнейшем вычислялся интегральный показатель по двум методам.
Статистическую обработку результатов исследования выполняли с помощью программы Med Calc Statistical Software (Бельгия). Характер распределения выборочных значений оценивали с помощью критерия Шапиро–Уилка. Поскольку все вариационные ряды продемонстрировали нормальное распределение, результаты представлены в виде среднего арифметического значения и ошибки выборочного среднего (M ± m). Достоверность различия выборочных средних оценивали с помощью t-критерия Стьюдента. Нулевая гипотеза отвергалась при значении порога доверительной вероятности р < 0,05.
Результаты
Среднее количество тромбоцитов в цельной крови, взятой для исследования, в 1-й группе составило 273,2 ± 15,8 тыс/мкл, что соответствовало нормальным показателям содержания тромбоцитов в периферической крови человека. Во всех подгруппах после применения различных режимов центрифугирования терапевтической концентрации тромбоцитов в верхних слоях образцов не зарегистрировано, количество тромбоцитов определялось в пределах от 175,3 ± 9,3 до 401,6 ± 22,7 тыс./мкл. После проведения первого режима центрифугирования со скоростью 1000 об./мин (184 g) в течение 5 мин содержание тромбоцитов в верхнем слое образца плазмы составило 401,6 ± 25,3 тыс./мкл, в среднем слое – 891,8 ± 37,2 тыс./мкл, в нижнем слое – 1136,1 ± 44,4 тыс./мкл (рис. 2).
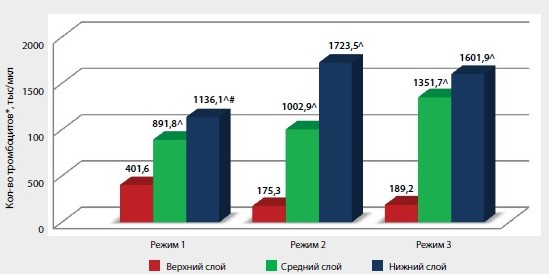
Рисунок 2. Концентрация тромбоцитов в образцах плазмы 1-й группы
Прим.: ^ р < 0,05 относительно показателей для верхнего слоя внутри подгруппы; # р < 0,05 относительно показателей для верхнего слоя между подгруппами; * cреднее арифметическое от медианных значений количества тромбоцитов по Фонио и при их подсчете в камере Горяева
Наибольшую концентрацию тромбоцитов в нижнем слое образца плазмы – 1723,5 ± 125,4 тыс./мкл удалось получить при проведении второго режима центрифугирования со скоростью 1500 об./мин (415 g) в течение 10 мин. При этом в среднем слое образца также отмечалась достаточно высокая концентрация тромбоцитов, чтобы считать эту плазму обогащенной – 1002,9 ± 77,1 тыс./мкл. В результате центрифугирования образцов плазмы подгруппы 3 в режиме 3000 (1660 g) об./мин в течение 10 мин получены наибольшие показатели концентрации тромбоцитов в среднем слое образца – 1351,7 ± 96,3 тыс./мкл. Статистически достоверной разницы в этих случаях между средним и верхним слоем, концентрация тромбоцитов в котором составила 1601,9 ± 113,6 тыс./мкл, не выявлено (р = 0,041). Наименьшее количество примесей в виде лейкоцитов определено в верхних и средних слоях образцов плазмы – от 0,3 до 0,6 тыс./мкл (рис. 3).
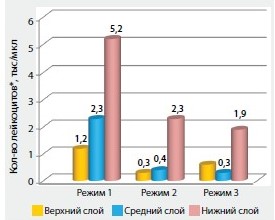
Рисунок 3. Концентрация лейкоцитов в образцах плазмы 1-й группы
В нижних слоях плазмы во всех случаях определялась высокая концентрация лейкоцитов в пределах от 1,9 до 5,2 тыс./мкл. Среднее количество тромбоцитов цельной крови
перед центрифугированием пробирок из группы 2 составило 273,2 ± 19,8 тыс./мкл. При центрифугировании пробирок, содержащих сепарационный гель, в режиме 2000 об./мин (738 g) в течение 10 мин нам не удалось добиться терапевтической концентрации тромбоцитов ни в одном случае. Среднее содержание тромбоцитов в верхнем слое образца плазмы составило 23,1 ± 1,4 тыс./мкл, в нижнем слое – 210,1 ± 12,2 тыс./мкл. При этом в верхнем слое плазмы примеси в виде лейкоцитов не обнаружены
вообще, в нижнем слое образца концентрация лейкоцитов составила 0,1 ± 0,05 тыс./мкл.
Обсуждение
Концентрации тромбоцитов и лейкоцитов в образцах плазмы, полученных при разных режимах центрифугирования, имеют существенные различия. Показатели количества тромбоцитов в нижних слоях плазмы в группах 1 и 2 соответствуют данным исследования, в котором использовались пробирки без сепарационного геля и с ним, а также специализированные пробирки для получения PRP. При этом в данной работе нет сведений об алгоритме отбора проб плазмы и ее количестве для анализа. Существуют данные о методиках, позволяющих получить концентрацию тромбоцитов более 2500 тыс./мкл, с применением больших объемов плазмы и двойного центрифугирования, что не удалось достичь в нашей работе. В то же время есть мнение, что важное значение имеет не столько концентрация тромбоцитов, сколько их целостность.
Доказано,что количество выделяемых факторов роста не коррелирует с концентрацией тромбоцитов в PRP, а скорость их высвобождения выше в гелеобразных образцах плазмы. Кроме того, ряд авторов указывают, что при очень высокой концентрации тромбоцитов возможен также процесс аутоактивации и парадоксальный ингибирующий эффект PRP на процессы регенерации. Кроме того, во многих работах описано применение специализированных устройств для получения PRP, но их использование предусматривает неизбежно высокое содержание лейкоцитов в получаемых препаратах (в среднем от 11,0 до 27,3 тыс. клеток в мкл), что не соответствует полученным нами данным.
Существуют противоречивые точки зрения на влияние примесей в PRP. Присутствие лейкоцитов в плазме, обогащенной тромбоцитами, предположительно оказывает положительный эффект в связи с их антибактериальной активностью, но имеющийся воспалительный потенциал лейкоцитов, содержащихся в плазме, может существенно повлиять на течение раневого процесса в целом. При получении собственных образцов PRP мы старались минимизировать количество лейкоцитарных примесей для профилактики развития возможных провоспалительных процессов.
Разнообразие методов получения препаратов PRP является причиной отсутствия стандартизации технологий и качества оценки результатов их применения. В большинстве отечественных и зарубежных источников методы получения PRP путем центрифугирования цельной крови описываются техническими характеристиками, включающими число оборотов центрифуги в минуту и время проведения центрифугирования, например, 3600 об./мин в течение 10 мин или 2300 ±140 об./мин в течение 14 мин. Следует отметить, что использование показателя числа оборотов в минуту для сравнения полученных результатов у разных авторов и на разном оборудовании теряет смысл, так как значения центробежной силы, благодаря которой и осуществляется процесс сепарации клеток крови при центрифугировании, напрямую зависят не только от количества оборотов в минуту, но и от радиуса центрифуги, и будут различаться друг от друга.
Выбранный нами наиболее оптимальный режим – 1500 об./мин (415 g) в течение 10 мин, возможно, предотвращает разрушение стенок тромбоцитов, так как количество поврежденных клеток напрямую зависит от скоростных параметров и времени проведения процедуры. Известно также, что при ускорении 400 g спонтанная активация тромбоцитов составляет 5%. В настоящее время нет данных об изучении соотношения числа целых и разрушенных тромбоцитов в образцах плазмы, полученных при разных
режимах центрифугирования. Однако некоторые авторы сообщают о выраженном клиническом эффекте применения плазмы с содержанием тромбоцитов, в 1,5–2 раза превышающим базовую концентрацию, при доказанной целостности клеток по данным электронной микроскопии. Имеются данные о клинически эффективных образцах плазмы с концентрацией тромбоцитов ниже 106/мкл, полученные при малых значениях центробежной силы и однократном центрифугировании, что позволяет рассматривать возможность применения предложенных нами режимов в практике лечебных учреждений.
Стоит отметить, что использование пробирок с литий-гепарином и сепарационным гелем при режиме центрифугирования 738 g в течение 10 мин позволило получить обедненную тромбоцитами плазму и минимизировать количество лейкоцитарных примесей в образце. Полученный результат может быть обусловлен связыванием тромбоцитов с тиксотропным гелем, являющимся полимером и обладающим высокой вязкостью.
Заключение
Максимальными по количеству тромбоцитов являются образцы плазмы нижнего слоя, полученные при режимах центрифугирования 415 и 1660 g в течение 10 мин с использованием пробирок, не содержащих сепарационный гель. При этом образцы среднего слоя с использованием данных режимов содержат более 106/мкл тромбоцитов и менее 103/мкл лейкоцитов и также могут быть использованы в терапевтических целях. Следует учитывать, что отбор плазмы из нижнего слоя полученного образца после центрифугирования всегда сопровождается включением в ее состав лейкоцитов, что может приводить к нежелательным провоспалительным реакциям при ее применении.
Необходимы дальнейшие фундаментальные научные исследования для определения клинически значимой роли концентрации различных клеточных компонентов в обогащенной тромбоцитами плазме.
Источник:
Базлов C.Б., Мелконян К.И., Русинова Т.В., Попандопуло К.И., Марченко Н.В., Шевчук Д.Д. К вопросу о получении плазмы, обогащенной тромбоцитами. Инновационная медицина Кубани. 2022;(1):38–43. https://doi.org/10.35401/2500-0268-2022-25-1-38-43
прочитано
6862
раза